Ørsmå organer kan nå vokse på en mikrochip – det gir oss banebrytende kunnskap
Ved hjelp av stamceller kan vi nå dyrke fram såkalte organoider; en bitteliten liten lever, et ørlite hjerte eller en tynntarm i laben. Mikro-organet kan deretter kobles til en mikrochip som simulerer biologiske prosesser. Denne sammenkoblingen kalles “organ-on-a-chip” og åpner for uante forskningsmuligheter.
– Med denne teknologien kan vi studere og etterlikne fosterstadiet, etterlikne en menstruasjonssyklus, eller studere hvordan kreft spres, for å nevne noe. Og ikke minst: denne teknologien forventes å minimere andelen dyreforsøk, forteller forsker Frøydis Sved Skottvoll i SINTEF.
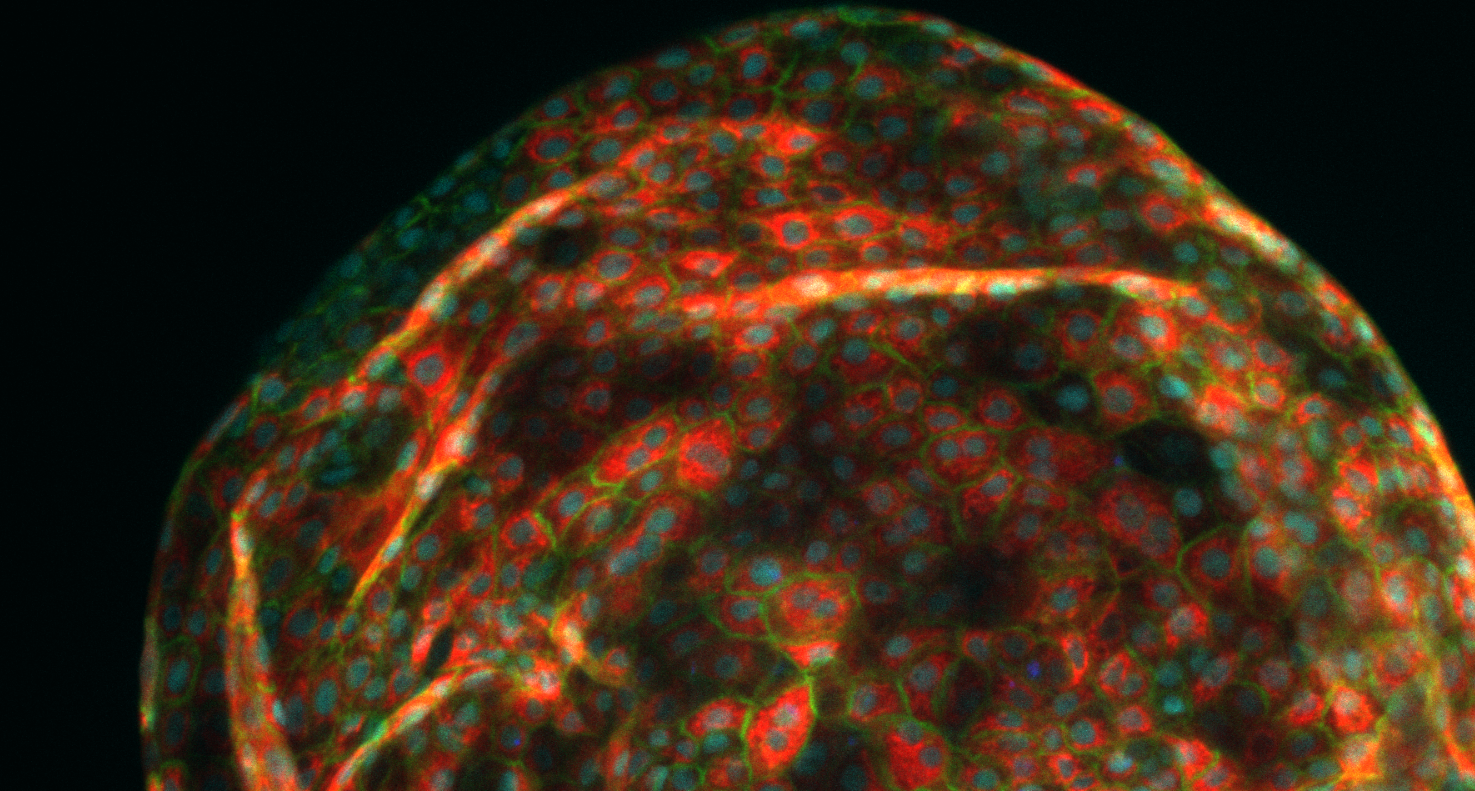
Organoide av leverceller, utviklet av Aleksandra Aizenshtadt i forbindelse med Skottvoll sitt doktorgradsarbeid ved UiO. Foto: Aleksandra Aizenshtadt/ Hybrid Technology Hub.
Det hele startet med japaneren Shinya Yamanaka. Han revolusjonerte stamcelle-verden, da han lyktes med å reprogrammere en hudcelle til å bli en stamcelle. På denne måten ble stamceller plutselig allment tilgjengelig. Nyvinningen ga Yamanaka Nobelprisen i medisin i 2012.
Noen år senere klarte forskere å gro de første mini-organene med en stamcelle som utgangspunkt; det som i dag kalles organoider. Nå jobbes det med å utvikle teknologien – rettere sagt den delen av teknologien som handler om mikrosystemet organoidene studeres i.
– Dette gjør vi ved å bruke fabrikasjonsmetoder fra databrikke-industrien til å utvikle skreddersydde mikrokanaler og sensorer som simulerer kroppens egne prosesser. I tillegg kan vi måle hvordan organoidene har det inne i mikrosystemet, forklarer SINTEF-forskeren.
Hva er egentlig “organ on a chip”?
Teknologien består av to elementer: Et miniorgan, dyrket fram av en stamcelle, og en bitteliten og tredimensjonal brikke som består av ørsmå kanaler på hver sin side av en membran. I disse kanalene kan forskerne tilsette ulike molekyler som gir cellene ulike signaler, og deretter påvirke gjennomstrømningen av dem.
Membranen fungerer som en porøs skillevegg som gjør at molekyler kan diffundere, altså transporteres, mellom to ulike mini-organer, litt som blodåreveggen. Målet er å simulere den biologiske aktiviteten som skjer på cellenivå i kroppen.

For å modellere menneskekroppen, er det mulig å konstruere brikker med ørsmå kanaler og mikrostrukturer som etterlikner kroppens egen mikrofluidikk; altså transporten av ulike stoffer til og fra cellene våre. Dette er en av de mikroskopiske strukturene som har blitt til i laboratoriet til SINTEF. Kanalene på bildet er bare noen mikrometer dype og brede. Foto: SINTEF
– Teknologien kan også brukes til å simulere for eksempel det som kalles blod-hjerne-barrieren. Dette er kroppens “sikkerhetsmekanisme” for å beskytte at det ikke lekker stoffer mellom hjernen og blodbanen. Hjernen ligger altså helt atskilt fra blodbanen, noe som i utgangpunktet er bra, men som kan være en ulempe vi vil inn i hjernen med for eksempel medisiner, utdyper Skottvoll.
Historisk sett har det vært veldig vanskelig å studere denne funksjonen i mennesker. Men med “organ on a chip” har dette blitt mulig.
- Her kan du lese hva Wikipedia skriver om Organ på brikke
…men hva er en stamcelle?
I tillegg til å ha en mikrostruktur som kan etterlikne biologien i en celle, trengs det en stamcelle som “frø” for prosessen. Men hva er egentlig det?
I følge Bioteknologirådet er stamceller utgangspunktet for alle kroppens celler og vev, men er også ansvarlige for vedlikehold og reparasjoner av skadet vev. Disse cellene har en unik evne til å fornye og dele seg over lang tid. De kan også danne mer spesialiserte celler gjennom en prosess som kalles celledifferensiering. Da kan en stamcelle blir “mor” til alt fra blodceller til muskelceller. Men en stamcelle kan aldri bli til kjønnsceller.
– Om vi vet hva som skal til, er det litt som å stelle en surdeig: Den første dagen gjør du ett steg. Dagen to tilsetter du noe annet, deretter må man røre, vente og etter hvert tilsette flere ingredienser. Slik kan vi fortsette til vi ser at cellene har blitt til et miniorgan. Noen ganger likner de til og med på et faktisk organ i fasongen, forteller Skottvoll.
Organoider kan gi oss mange svar
SINTEF-forskeren var tidlig ute med å fange interesse for teknologien. Allerede som doktorgradsstipendiat ved Universitetet i Oslo begynte hun å jobbe med “organ-on-a-chip”. Det forskeren så på var rett og slett hvor mye en minilever likner på en ekte lever når den ble “utsatt” for ulike legemidler. ( Se hovedbildet i saken.)
– Det jeg fant var at de er veldig like en menneskelever. Men at de er litt “tregere” enn et ekte organ når det gjelder å bryte ned medisinene. I praksis betyr det at forsøk på slike organer kan ta tid, fordi mini- organet ikke er “helt ferdig”. Vi tror at årsaken til dette er at organene enda ikke har utviklet blodårer, slik at det ikke er et system som kan frakte medisiner rundt i organet, sier SINTEF-forskeren.
Kan simulere “alt”
Den fysiske forutsetningen for “organ-on-a-chip” er altså en mikroskopisk struktur som består av ulike kanaler og membraner. Og det er slike fysiske mikrostrukturer som nå blir til i SINTEF MinaLab i Gaustadbekkdalen i Oslo.
– Like viktig som å lage organ-on-a-chip, er det å måle hva som egentlig skjer. Derfor utvikler vi også sensorteknologi som kan automatisk overvåke og måle på hvordan mini-organene har det på chipen, sier Skottvoll.
Farvel til dyreforsøk og raskere utvikling av medisiner?
I framtida kan det altså hende at dyreforsøk blir unødvendig, at vi kan dyrke fram organer i stedet for å bruke organdonorer, og at vi kan teste ut behandlingsmetoder og medisiner på “ekte” organer.
I dag er det faktisk mulig å stimulere celler på så avanserte måter at vi kan simulere for eksempel fosterutviklingen “in vitro” – altså i en cellekultur i et laboratorium.
– Dette er naturligvis en arena som åpner for en rekke etiske diskusjoner om hva som er forskningsetisk riktig. Særlig debatten om hjerneorganoider er et “hot” tema om dagen, sier Skottvoll
Men det er ikke tvil om at dette er en teknologi som kan brukes til å gi oss mer effektive behandlingsmetoder, ikke minst innenfor det som kalles persontilpasset medisin.
Ifølge SINTEF-forskeren kommer dette til å endre måten vi velger riktig behandling til pasienter på.
– Hvis pasienten har kreft i leveren, kan vi gro en pasientspesifikk mini-lever, og bruke organ-on-a-chip til å simulere hvordan ulike behandlinger og medisiner påvirker kreften og pasientens lever. På denne måten kan vi unngå at behandlinger ikke fungerer, eller personspesifikke bivirkninger fra medisiner, sier Frøydis Sved Skottvoll
- Her kan du lese mer om organoider og den etiske debatten rundt dette.