Ny metode baner vei for nye antibiotika
Ved NTNU har man nå en lovende kandidat for antibiotika mot resistente gule stafylokokker. Bak funnet ligger metodikk som kan bli viktig i kampen mot antibiotika-resistens.
– Antibiotika-resistens er et stort problem. Å kunne bidra til å løse det er veldig kjekt, sier stipendiat Amanda Holstad Singleton.
Hun er førsteforfatter på en studie som viser hvordan to nye stoffer i kombinasjon effektivt dreper antibiotikaresistente gule stafylokokker (MRSA).
Stoffene er utviklet på NTNU og kan bli et helt nytt antibiotikum, effektivt mot en bred gruppe bakterier.
– En ting er at vi har utviklet nye antibiotika-kandidater, som i kombinasjon viser seg å tolereres godt av menneskelige celler. Men like viktig er det at vi har utviklet en teknologi for å studere hvordan antibiotikumet virker inne i bakteriecellene, sier Singleton.
Rødt lys for indre prosesser
For å kunne analysere hvordan de to stoffene virket, har forskerteamet ved NTNU utviklet en metode som analyserer hvordan bakteriens signalproteiner reagerer på behandlingen. Metoden gir forskerne et helt nytt verktøy i jakten på nye antibiotika-kandidater.
– Inne i en bakteriecelle kan det være opp til 10.000 proteiner. I stedet for å se på alle disse, «fisker» vi ut de rundt 2000 proteinene som virker som signalproteiner. Disse proteinene styrer mye av det som skjer i cellene.
Metoden gir forskerne mulighet til å se om hvert enkelt av disse proteinene er aktivert eller deaktivert etter at man har tilsatt stoffet man vil teste ut.
– Disse proteinene kan sammenlignes med trafikklys, som kan skifte fra rødt til grønt og tilbake igjen. Ved å få dem til å skifte til rødt, stopper man en viktig signalvei inne i cellen, forklarer Singleton.

Amanda Holstad Singleton er førsteforfatter på en studie som viser hvordan to nye stoffer i kombinasjon effektivt dreper antibiotikaresistente gule stafylokokker. Stoffene tåles godt av humanceller, noe som gjør dem til en lovende kandidat for et nytt antibiotikum. Foto: Jana Scheffold
Finner man et stoff som påvirker et slikt signalprotein til å gi rødt lys for en sentral prosess i cellen, har man funnet en kandidat til et nytt antibiotikum. Finner man stoffer som kan gi rødt lys på flere ulike steder i cellen, har man en enda bedre kandidat.
Og det er nettopp det forskerne ved NTNU har gjort når de nå har kombinert to ulike stoffer som kan bli et nytt antibiotikum.
– I en studie nylig publisert i tidsskriftet Frontiers in Microbiology, viser vi at to nye stoff utviklet ved NTNU i kombinasjon dreper antibiotikaresistente gule stafylokokker (MRSA) mye mere effektivt enn når de brukes hver for seg, sier Singleton.
Hindrer kopiering av DNA
Det var for snart fire år siden at forskerne ved Institutt for klinisk og molekylær medisin ved NTNU publiserte de bakteriedrepende egenskapene til en bestemt type peptider. Det er disse, i kombinasjon med et stoff utviklet ved NTNUs Institutt for kjemi, som nå kan bli et helt ny type antibiotikum.
– Peptider er kjeder av aminosyrer, som er byggesteiner i proteiner. Det spesielle med akkurat disse peptidene er at de binder seg til et protein i bakteriene som er helt essensielt for at bakterier skal kunne kopiere sitt DNA, sier professor Marit Otterlei.
Peptidet hindrer DNA-kopieringen. Dermed dør bakterien.
– Ingen andre antibiotika angriper dette proteinet. Det betyr at det er et nytt «target», og det finnes derfor heller ikke bakterier som er resistente mot disse peptidene. Siden dette mål-proteinet finnes i alle bakterier, virker disse peptidene også på multiresistente bakterier, sier Otterlei.
Synergieffekt
Samtidig som at Otterlei og kollegene jobbet videre med peptidene, drev forskerne Eirik Sundby og Bård Helge Hoff på NTNUs Institutt for materialteknologi og Institutt for kjemi et arbeid med å finne stoffer som effektivt hindret dannelsen av selve byggesteinene i DNA. De hadde også utviklet stoffene, såkalte kinaseinhibitorer, som kunne brukes i metoden for å fiske ut signalproteiner fra bakterieprøvene.
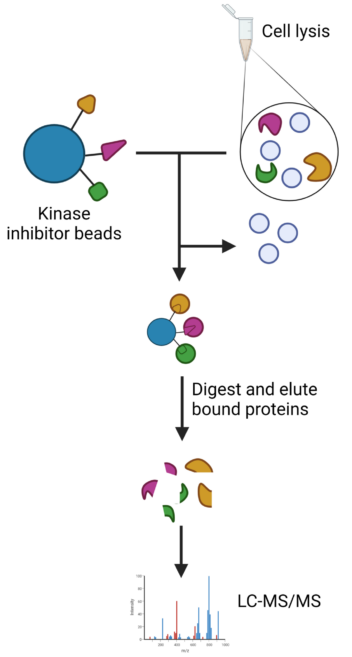
For den faglig interesserte: Ved å sammenligne celleekstrakt («cell lysis») fra ubehandlede og behandlede bakterier kan man se hvilke proteiner som har endret seg. Celleekstraktet inneholder «trafikklys-proteiner», proteiner som er involvert i ulike bakterielle signalveier. Ved å bruke kuler hvor det er festet kinaseinhibitorer, kan man selektere for aktiverte proteiner som har et tilgjengelig ATP-bindende sete (grønt trafikklys). Det gir innblikk i hvilke cellulære prosesser som er aktive eller deaktiverte, og gir dermed verdifull informasjon om cellens respons på antibiotika. Ill: Amanda Holstad Singleton
– Da vi hadde metoden klar, testet vi den på bakterier behandlet med peptider i kombinasjon med et av disse nye molekylene som man trodde påvirket produksjon av byggesteiner til DNA. Vi fant at de nye molekylene hadde en annen virkningsmekanisme enn man trodde, men at de hadde en veldig god kombinasjonseffekt, en synergistisk effekt, med våre peptider, sier Otterlei.
Det viste seg at de nye molekylene til Sundby og Hoff hindret selve energiomsetningen inne i bakteriecellen. I kombinasjon med Otterleis peptider, førte de også til aktivering av proteiner knyttet til stressresponser i bakteriecellene. Det skjedde ikke om stoffene ble tilført hver for seg. Denne ekstra aktiveringen førte til at bakteriene døde mer effektivt.
Ifølge forskerne er det første gangen man studerer virkingen av antibiotika på denne måten.
– Dette gir oss en helt nye måte å vurdere nye antibiotika-kandidater på, sier Otterlei.
Hindrer mutasjon som kan gi resistens
Det gir også forskerne en ny måte å hindre utvikling av resistens mot nye antibiotika.
– Vi må huske at å utvikle resistens er en naturlig del av evolusjonen. Det er uunngåelig. Men å utvikle resistens er kostbart for bakterien. Den må ofre noe, sier Otterlei.
Det er to måter bakterier kan utvikle resistens mot antibiotika på, forklarer Singleton. Enten ved at bakterien kommer i kontakt med andre bakterier som allerede er resistente, og utveksler DNA seg imellom. Eller at det skjer en mutasjon i bakteriens gener som gir den beskyttelse mot antibiotikumet.
– Slike mutasjoner koster, det går utover bakteriens «fitness». Man ofrer en egenskap, for å oppnå en annen som beskytter mot antibiotikumet.
Men om fordelen ved å være beskyttet mot antibiotikumet overgår ulempen, vil bakterien formere seg, og vi får mange nye antibiotika-resistente bakterier.
Skal bakterien derimot klare å utvikle resistens mot to stoffer samtidig, som virker på helt ulike steder inne i bakteriecellen, blir det verre.
– Angriper man to ulike prosesser, vil det å utvikle resistens mot begge bli en altfor stor belastning, og bakteriene blir mindre levedyktige, sier Singleton.
Ekstra vanskelig blir det om man i tillegg lager et antibiotikum som angriper selve måten bakterien utvikler resistens på.
– I vårt tilfelle er proteinet vår nye antibiotika-kandidat angriper så sentralt for bakterien for å kunne kopiere DNAet sitt før den formerer seg, at om det oppstår en mutasjon her blir tapet av fitness så stort at bakterien dør av det, sier Singleton.
Kilde:
Amanda Holstad Singleton, Marit Ottelei mfl: Frontiers | Activation of multiple stress responses in Staphylococcus aureus substantially lowers the minimal inhibitory concentration when combining two novel antibiotic drug candidates (frontiersin.org)
Mer om forskningsprosjektet TAMIR – Targeting antimicrobial resistance by inhibition of bacterial stress responses