Dreper kreftceller med superlim
Med nanokapsler som inneholder kreftmedisin, har forskere lyktes med å angripe kreftsvulster med kirurgisk presisjon. Kapslene er blant annet framstilt av ørsmå dråper med superlim.
Den nye måten å transportere medisin på er allerede testet ut med gode resultater på kreft i mus og rotter. Den kan i tillegg åpne for helt ny behandling av sykdommer i hjernen, som Alzheimers og Parkinsons, ifølge forskere ved SINTEF.
Forskerne her står bak utviklingen av en type nanokapsler som utnytter svulstens svake punkt, blodkar av dårlig kvalitet. De svake blodkarene oppstår fordi svulster vokser svært raskt.
– Det medfører at det rett og slett er lettere for oss å trenge igjennom dem og plassere medisin direkte inn i svulsten, forklarer forsker Ýrr Mørch, som er spesialist innenfor nanomedisin i SINTEF.
Gasseksplosjon i nanoformat
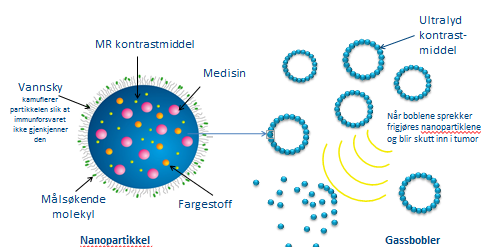
Nanokapslene transporteres inn i blodbanen ved hjelp av gassbobler og utskiller kreftmedisinen når de kommer fram til svulsten som skal behandles. Boblene brukes også til å gi medisinen et ekstra dytt når den trefferblodkarene i selve svulsten. Men å gjøre gassbobler stabile så de kan transporteres rundt i blodbanen, er ingen enkel sak:
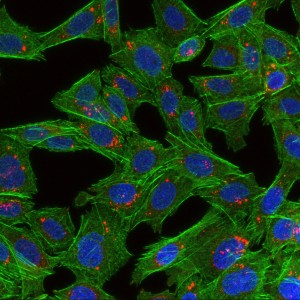
Bildet viser celler som har spist nanopartikler. Cellene er grønne, cellekjernene er blå og det røde er nanopartiklene. Foto: Habib Baghirov, NTNU.
– Se for deg det som skjer når man blåser inn små gassbobler i vann gjennom et sugerør. De stiger til overflaten og sprekker. Utfordringen vår har derfor vært å hindre nettopp dette. Det har vi gjort ved å modifisere overflata til nanopartiklene, slik at de legger seg som et skjold rundt selve gassboblen, forteller seniorforsker Per Stenstad, som jobber tett med Mørch i dette prosjektet.
– Vi har faktisk lyktes i å gjøre dem så stabile at de kan lagres på glass i mer enn ett år, sier han.
Stenstad forklarer at selve gassboblene er ti ganger større enn partiklene – men så små at de ikke kan sees med det blotte øye. Allikevel spiller de en nøkkelrolle for at medisinen skal treffe nøyaktig der den virker mest.
Både diagnoseverktøy og behandling
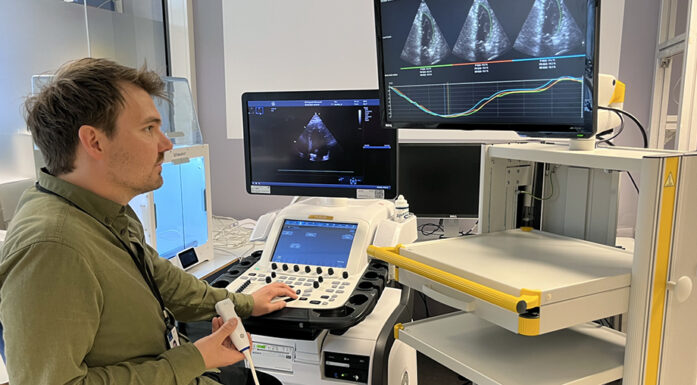
I et nabobygg til St. Olavs hospital står SINTEF-forsker Rune Hansen ved en gjennomsiktig boks som ser ut som noe helt annet enn et ultralydapparat. Men det er nettopp hva det er – riktignok spesialdesignet for rotter.
– Vi bruker ultralyd til å sette gassboblene i vibrasjon når medisinen har kommet fram til tumor. Effekten er omtrent som når man blåser opp en ballong og slipper ut lufta flere ganger med høy frekvens. Det er dette som gjør at vår teknologi virker så godt: De vibrerende gassboblene sørger for at blodkarene en kort stund åpner seg litt opp slik at nanopartiklene som inneholder medisin, kan slippe ut av blodkarene og videre inn i svulsten, forklarer Hansen. Her går de i oppløsning, frigir cellegift og dreper kreftcellene.
Hansen har jobbet mange år med ultralyd som både diagnose- og behandlingsmetode i tett samarbeid med NTNU og medisinerne ved St. Olavs hospital. Nå er utfordringen hans å finne den nøyaktig rette ultralydteknologien til dette formålet. Og så langt virker det – på de små gnagerne.
En annen fordel med metoden er at medisinen faktisk kjenner igjen svulsten:
– Kapslene inneholder målsøkende molekyler. Derfor vil de trekkes mot svulsten. Det har to nyttige bruksområder, forklarer Mørch:
Det første er at kapslene kan varsle om det finnes en svulst – og dermed gi raskere diagnose.
Det andre er at svulsten faktisk trekker til seg medisin, slik at behandlingen blir mer effektiv.
Færre bivirkninger – mer effekt
I tillegg til at en større del av medisinen treffer selve kreftsvulsten, vil denne behandlingsformen gi færre bivirkninger for pasienten – fordi metoden er konstruert for å virke svært lokalt. Det gjør at man bare behandler det syke vevet.
Litteraturstudier visert at lokal medisinering gjør at svulsten blir eksponert for en langt større medisindose enn ved “klassisk” cellegiftbehandling:
– Ved cellegiftbehandling er det faktisk mindre enn 0,1 prosent av medisinen som går til tumor. Resten havner i lever, nyrer og andre organer. Da gir medisinen ofte bivirkninger og er til liten nytte. Litteraturstudier viser at når man derimot bruker målrettet behandling av det syke vevet, vil opptil 5–6 prosent av medisinen nå fram til tumor, slik at de skadelige virkningene av medisinen blir mindre. Derfor er dette en tryggere form for behandling, sier Mørch, som opplyser at målet er å nå 10 prosent effekt av den målretta behandlingsmetoden.
Lær om fordelene med nanomedisin:
Dette åpner for å benytte svært effektive kreftmedisiner som i dag ikke er på markedet fordi de har for mange bivirkninger.
– Kort oppsummert vil dette gi oss muligheten til å gi pasientene mindre medisin samtidig som det går mer målrettet behandling på selve tumoren, sier Mørch.
Stealth-partikler
En utfordring forskerne jobber med, er å gi kapslene en form for kamuflasje, slik at kroppens eget immunforsvar ikke angriper den knøttlille medisinpakken og ødelegger den før den når målet.
Fra Ugelstadkuler til ultralyd
Miljøet her på SINTEF har mer enn tretti års erfaring med utvikling av partikler for ulike biokjemiske og medisinske anvendelser . Best kjent er nok de såkalte "Ugelstadkulene" (Dynabeads) som ble til her allerede i 1978. Kulene kan gjenkjenne bestemte celler og bakterier og brukes blant annet når det er behov for å trekke ut bestemte celletyper, for eksempel fra en blodprøve – og i kreftbehandling, for å nevne noe.
– Da bruk av nanopartikler for medisinering begynte å få oppsving 10-15 år siden, var det naturlig at også SINTEF fattet interesse for fagområdet. Partikkelerfaringen ble overført og utvidet til partikler og kapsler med mindre størrelse. I dag har vi spesialister innen både parktikkeldesign og nanomedisin her på huset – og det gjør at vi kan utvikle mange spennende løsninger, forteller Ruth Schmid, som er markedsdirektør for området.
De siste 3-4 årene har miljøet her også sett utenfor eget fagfelt. Og det er det som gjør at de nye nanokapslene blir så effektive:
– Vi har koblet på ultralydkompetansen i SINTEF og ved NTNU. Den nye behandlingsmetoden kunne ikke ha blitt utviklet uten samarbeid på tvers, sier Schmid.
Mange miljøer jobber med nanopartikler for levering av medisiner. Det som er spesielt med dette prosjektet er at partiklene fremstilles i ett trinn og at vi kobler dem på gassbobler for mer effektiv levering og kombinert diagnostikk (avbildning) og terapi.
– Kroppen er svært dyktig til å kjenne igjen fremmedlegemer. Derfor var en av utfordringene våre å utvikle en metode som gjør at kroppen ikke oppdager dem.
Dette gjøres ved å framstille kapslene på en måte som gjør at kroppen oppfatter dem som små vanndråper. Kamuflasjen består av et tynt lag med lange polymerer som trekker til seg vannet og danner en liten vannsky rundt kapselen.
– Kroppen bruker lengre tid på å oppdage partiklene på denne måten, så vi kjøper oss tid til å få dem inn til svulsten, sier Mørch. Hun tilføyer at teknologien har fått navnet Stealth-teknologi etter de avanserte jagerflyene som ikke kan sees på radar fordi de blant annet er behandlet med et bestemt belegg.

Nanokapslene tilsettes farge, slik at forskerne lettere kan se om de fungerer som de skal når de treffer svulsten. Foto: Christina Benjaminsen.
Billig framstilling i store kvanta
Framstillingsmetoden for de spesielle partiklene foregår i én og samme operasjon. Det gjør at produksjonen er forholdsvis enkel og samtidig svært kostnadseffektiv.
– Litt enkelt forklart kan vi si at vi lager små dråper av lim (nanodråper), og disse blandes med medisinen. Dette limet er det samme som brukes til å lime sammen sår. Deretter herdes dråpene ved hjelp av en komponent. Limet brytes så ned i kroppen over tid og frigir etter hvert medisinen, forklarer forskeren.
 Selve nanopartiklene blir til i en reaktor. Deretter piskes luft og proteiner inn i løsningen for å lage luftbobler, som nanopartiklene fester seg utenpå.
Selve nanopartiklene blir til i en reaktor. Deretter piskes luft og proteiner inn i løsningen for å lage luftbobler, som nanopartiklene fester seg utenpå.
Gir håp for hjernesykdommer
Den spesielle teknologien som utnytter partiklenes evne til å produsere gassbobler, kan også få stor betydning for framtidig behandling av hjernesykdommer som Alzheimers og Parkinsons.
– Vi vet at det er vanskelig å nå hjernen med medisiner fordi den er omkranset av en svært effektiv barriere som skiller blodbanen fra spinalvæsken. Dette er for å beskytte hjernen mest mulig for skadelige stoffer i blodet. Derfor er vi nå i gang med forsøk sammen med fysikere ved NTNU. Målet er å finne ut hvor sterk ultralyd vi må bruke for at gassboblene klarer å trenge igjennom denne barrieren som beskytter hjernen vår. Om vi lykkes vil det bli mulig å transportere medisiner inn til en del av kroppen som vi i dag ikke kan nå.
Hva skjer etterpå?
En stor del av forskningen går ut på å undersøke hva som skjer med partiklene etter at de har gått i oppløsning og “gjort jobben”.
– Partiklene vil ikke eksistere lenger, men det vil noen av komponentene. Vi vet at disse kan være giftige i høye konsentrasjoner. Derfor er det viktig å få kunnskap om hvordan de påvirker både menneske og miljø i etterkant. Fordelene må være større enn ulempene, understreker Ýrr Mørch.
Konsernsatsing Medical ACTION:
Siden 2006 har SINTEF gjort en rekke interne satsinger på utvalgte forskningsfelt. Konsernsatsingene er basert på vår strategi for å investere egne midler i kompetanse. Medisinsk teknologi og nanomedisin ble utpekt som strategiske områder for SINTEF med stort potensiale for vekst og det ble derfor startet en intern strategisk satsing innen området hvor tre SINTEF institutt, SINTEF Materialer og kjemi, SINTEF Teknologi og samfunn og SINTEF IKT jobber tverrfaglig for å utvikle ny kompetanse og nye teknologiplattformer. Målet for satsingen er at SINTEF skal være foretrukket partner i store internasjonale prosjekt innen deler av medisinsk teknologi, som in vitro diagnostikk og in vivo bildediagnostikk/behandling. Konsernsatsingen varer fra 2011 – 2014 med et budsjett på 6 MNOK per år. Markedsdirektør Ruth Schmid er prosjektleder .
Langt løp
Nå er utviklerne i dialog med SINTEFs eget kommersialiseringsselskap SINVENT for å sikre rettighetene til framstillingsmetoden av partiklene, før de går i dialog med både industri og investorer.
– Denne typen forskning er svært kostnadskrevende fordi farmasøytisk industri aldri går inn med penger før det er gjort forsøk på store dyr og mennesker og det er bevist at man har både effekt og lite bivirkninger.
– I dag er vi kommet så langt at studiene foregår preklinisk på små dyr. Neste steg vil være å teste ut dette i større dyr – sannsynligvis på griser.
Deretter må vi kunne vise at metoden er trygg. Om vi lykkes med det, er det klart for å gjøre farmasøytisk industri oppmerksom på hvor effektiv og kostnadseffektiv denne behandlingsmetoden er.
– Vi har stor tro på den fordi vi framstiller det hele i ett trinn – noe som gjør det mulig å produsere både mye og raskt. Selve framstillingen er svært kostnadseffektiv i stor skala. Men å få en ny medisin på markedet er et langt løp, understreker Ýrr Mørch.
Kan få stor betydning
Professor og overlege i urologi ved St. Olavs hospital i Trondheim, Anders Angelsen, har stor tro på denne typen behandling i framtida. Ikke minst i behandling av pasienter med prostatakreft.
– Om det blir mulig å behandle en lokalisert svulst med cytostatika ved hjelp av nanokapsler som kan frigi medisin ved hjelp av ultralyd, vil det ha stor betydning for både pasienten og behandlingsresultatet, sier han. Dette er en svært framtidsrettet behandlingsform, både rent kurativt og med tanke på bivirkingene, som kan være betydelige ved både operasjon og stråling, som er den lokalbehandlingen vi kan tilby i dag.
– Både inkontinens og ereksjonssvikt er vanlige bivirkninger som påvirker pasientene i stor grad. Det er derfor viktig å fortsette forskningen. Vi har jo et svært godt medisinsk miljø både innenfor ultralydassistert behandling og innenfor nanoteknologi her i byen, fremhever Angelsen.
Prosjektet er finansiert av Forskningsrådet, Helse Midt-Norge og SINTEF.