Hvordan noen bakterier utnytter immunforsvaret
Noen ganger angriper inntrengerne cellene som egentlig skal beskytte oss.
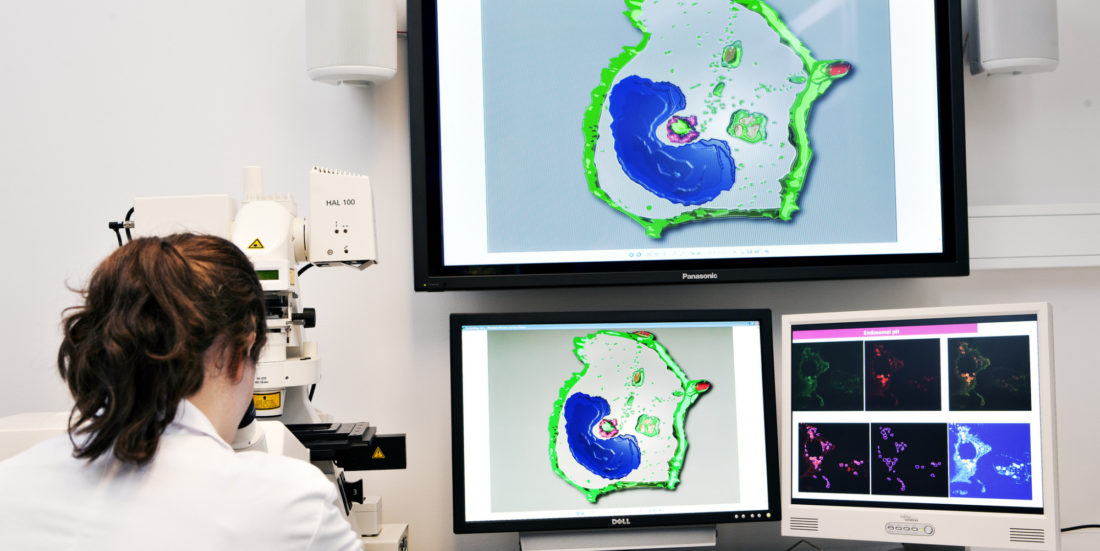
MYKOBAKTERIER: Menneskets immunforsvar er fantastisk. Hvis du kutter deg, mobiliserer kroppen din en rekke ulike proteiner og celler for å helbrede såret. Hvis du er infisert av virus eller bakterier, reagerer immunsystemet ved at celler angriper inntrengerne og nøytraliserer dem.
Men noen ganger angriper inntrengerne cellene som egentlig skal beskytte oss. Tuberkulose-bakterien Mycobacterium tuberculosis og dens mindre kjente (og mindre virulente) Mycobacterium avium gjør akkurat dette. De gjemmer seg i en bestemt type hvite blodlegemer som kalles makrofager, immunceller hvis hovedoppgave er å gjenkjenne og destruere mikrober og alarmere resten av immunforsvaret.
En gruppe forskere fra Norges teknisk-naturvitenskapelige universitet har identifisert et viktig steg i den mekanismen som gjør at mykobakteriene greier å lure immunsystemet og gjemme seg i makrofager.
Selv om funnet ikke får noen umiddelbare kliniske følger, gjør det at vi forstår mer av de generelle mekanismene for hvordan immunforsvaret fungerer, forklarer Trude Helen Flo, professor i cellebiologi og nestleder for Senter for molekylær inflammasjonsforskning (CEMIR).
– Vi tror dette er en generell mekanisme, og ikke bare begrenset til mykobakterier, sier hun.
Funnet gir viktig informasjon for å forstå hva som regulerer betennelsen og hvordan denne reguleringen kan gå galt. Fordi betennelsen som kroppen mobiliserer som et første skritt i immunresponsen også er knyttet til visse kreftformer, som for eksempel lungekreft, kan funnet ha implikasjoner også for kreft og flere andre sykdommer der betennelse er dysregulert.
Lady Windermere-syndromet
Flo og hennes kolleger er interessert i å vite mer om hvordan patogene mykobakterier greier å forbli i menneskekroppen fordi tuberkulose fortsatt er et globalt problem, spesielt i mindre utviklede land. Tuberkulose er også i ferd med å bli et problem igjen i utviklede land på grunn av antibiotika-resistente stammer av bakterien som gir lungesykdommen.
M. avium er en organisme som finnes overalt i naturen men som har mindre sannsynlighet for å forårsake sykdom hos friske mennesker. Bakterien kan imidlertid føre til store helseproblemer hos personer med nedsatt immunforsvar, for eksempel diabetes eller AIDS, hos barn, eller hos personer med lungeskader, sier Flo.
I det 18. og 19. århundre, da det ble ansett for uhøflig for kvinner av god stand å hoste, var det ikke uvanlig at velstående kvinner ble rammet av M. avium. Denne assosiasjonen med overklassen førte til at datidens leger kalte infeksjoner forårsaket av M. avium «Lady Windermere-syndromet» etter den kvinnelige karakteren i et skuespill av Oscar Wilde.
Slår immunsystemet på og av
Forskerne infiserte makrofager isolert fra friske blodgivere med M. avium for å studere rollen til et lite studert protein kalt Kelch-lignende ECH-assosiert protein, også kalt Keap1.
CEMIR
CEMIR, eller Senter for molekylær inflammasjonsforskning, er også utpekt til Senter for fremragende forskning.
Et sentralt spørsmål for CEMIR er hvordan inflammasjon kan være så nært knyttet til mange tilsynelatende forskjellige kroniske sykdommer.
CEMIRs forskningsprogram har som hypotese at nøkkelen til nye terapeutiske mål for kroniske inflammatoriske sykdommer finnes i de helt tidlige fasene av inflammasjonsresponsen hvor sensorer i det medfødte immunforsvaret aktiveres.
Når M. avium invaderer en makrofag, er den normale responsen til makrofagen å sende et signal – et rop om hjelp – til andre immunceller for at de skal komme og hjelpe. Dette signalet, i form av noe som kalles inflammatoriske cytokiner, forårsaker betennelse i kroppen.
– Men når denne betennelsesmekanismen er slått på, er den så sterk at kroppen reagerer svært raskt for å dempe reaksjonen, sier Flo. – Ellers, hvis reaksjonen blir ukontrollert, kan den være dødelig slik som en ser ved tilstanden septisk sjokk (blodforgiftning).
Forskerne fant at Keap1 bidrar til raskt å dempe immunforsvarets reaksjon når en makrofag er invadert av M. avium. Som også forklarer hvordan M. avium greier å forbli i makrofagen, sier Flo.

HUNT har samlet helse- og biologisk informasjon og materiale fra 120.000 mennesker siden starten i 1984.
– Keap1 er en negativ mekanisme for å kontrollere betennelsesreaksjonen, sier hun. – Men denne negative reaksjonen er også det som gjør oss utsatt for M. avium. En balansert immunrespons er viktig for å unngå septisk sjokk og kronisk betennelse, men kostnaden kan være at mykobakterier kan overleve i kroppen.
Forskerne brukte celler fra friske blodgivere i sin forskning istedenfor kreftcellelinjer som ofte brukes i slik forskning fordi de er enklere å jobbe med. Flo sier at mens bruk av celler fra blodgivere gjorde forskningen mer vanskelig og tidkrevende, ble også funnene mer verdifulle i forhold til eventuelle kliniske applikasjoner da de også tar høyde for biologiske forskjeller mellom individer.
Keap1-mutasjoner og kreft
Flo sier at en av grunnene til at Keap1 var av interesse for hennes forskningsgruppe var fordi mutasjoner i Keap1-genet er blitt funnet i krefttyper som også er forbundet med vedvarende betennelse, for eksempel bryst- og lungekreft.
Det betyr at Flo eller andre forskere kan se etter mutasjoner i Keap1 i blodprøver fra biobanker, som for eksempel Helseundersøkelsen i Nord-Trøndelag (HUNT) der NTNU er involvert. HUNT har samlet helse- og biologisk informasjon og materiale fra 120.000 mennesker siden starten i 1984.
– Vi kan se på pasientenes gener og se om de har ansamlinger av mutasjoner i Keap1, som bidrar i å regulere betennelsesreaksjonen, sier Flo.
Biobanker, som HUNT, har samlet inn data over flere tiår for at forskere for eksempel kan se hvordan forskjellige mutasjoner er assosiert med forskjellige kreftformer.
Keap1- funnet ble publisert 20. juli 2015 i PNAS, Proceedings of the National Academy of Sciences i USA.
Referanse: Keap1 regulates inflammatory signaling in Mycobacterium avium-infected human macrophages. Jane Atesoh Awuh, Markus Haug, Jennifer Mildenberger, Anne Marstad, Chau Phuc Ngoc Do, Claire Louet, Jørgen Stenvik, Magnus Steigedal, Jan Kristian Damås, Øyvind Halaas and Trude Helen Flo. PNAS. www.pnas.org/cgi/doi/10.1073/pnas.1423449112 PNAS. www.pnas.org/cgi/doi/10.1073/pnas.1423449112