Mikroskopisk kirurgi på fluefoster
Bananfluer egner seg ypperlig for genstudier, men håndtering av små mikroskopiske fluefostre krever teknologi på mikro- og nanonivå.
Bananfluer er 3 mm store, uanselige insekter som trives best på råtten frukt. Siden en begynte å studere dem for nesten 100 år siden, har de blitt en av de viktigste organismene i biologisk forskning.
Fluene er små og enkle å håndtere, har en kort utviklings- og livssyklus og er billige å holde i store antall. Dessuten finnes en mengde mutasjoner av bananfluer tilgjengelig for forskerne. Bananfluens genom er ett av de mest studerte, og ble “fullstendig” kartlagt i år 2000. En bananflue har ca. 14.000 gener, mens et menneske har 70.000.
Genmodifisering av bananfluer gir innsikt som ikke bare er vitenskapelig interessant, men som også kan bidra til å kurere sykdommer. At denne forskningen også er nyttig for menneskers helse, viser nobelprisen fra 1995, som gikk til Ed Lewis, Christiane Nusslein-Volhard og Eric Wieschaus for banebrytende forskning nettopp på bananfluer.
Mikroinstrumenter

Ralph Bernstein fra SINTEF Elektronikk og kybernetikk er på et års opphold ved Stanford University og med i forskningsteamet som driver prosjektet.
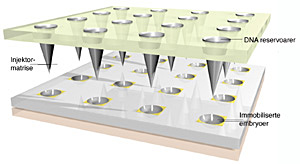
På bakgrunn av dette har forskere ved Stanford University satt i gang et treårig prosjekt finansiert av DARPA (Defence Advanced Research Projects Agency) for å forbedre metodene som benyttes i forskningen. Ideen er å utnytte mikroteknologi for å få bedre effektivitet og kontroll i eksperimentene, og å utvikle mikroinstrumenter til både håndtering, injisering og senere også sortering av de små fluefostrene (embryoene).
Ralph Bernstein, som er på ett års opphold ved Stanford University, er med i forskningsteamet som driver dette prosjektet, og teamet er en del av Microphotonics Laboratory som ledes av den norskfødte professoren Olav Solgaard.
Mikroinjeksjon
En viktig metode som benyttes i utviklingsbiologi, er å sprøyte inn substanser som vil påvirke sammensetningen til en celle eller en organisme. Mikroinjeksjon av slike transgener, dvs DNA-konstruksjoner som ofte består av et gen og en styringsdel, gir i mange tilfeller bananfluer med nye egenskaper siden transgenet blir integrert i fluens eget DNA. Dermed er det mulig å studere hvilke gener som har betydning for utvikling av organismen og hvilke organer som blir påvirket.
Fosteret til en bananflue er mindre enn en halv millimeter langt og en kvart millimeter i diameter. Mikroinjeksjon på embryoer utføres som oftest med mikrokanyler som stikkes inn i et embryo på én-celletrinnet eller i et væskefylt hulrom som finnes når det er på et meget tidlig utviklingsstadium (blastocyst-stadiet).
I dag framstilles kanylene ved å varme opp et glassrør som strekkes manuelt til det er “passelig” tynt. Deretter gjøres injeksjonene på ett og ett embryo under mikrosop; et arbeid som er svært tidkrevende. En ulempe med glasskanylene er at dimensjonene blir svært varierende, noe som gir liten kontroll over den injiserte mengden. Dessuten er det en grense for hvor tynne glasskanylene kan lages. Dette har betydning både for hva slags eksperimenter forskerne kan gjøre og hvor stor skade kanylen gjør på embryoet.
Hight tech mikrokanyler

Mikrokanyle (øverst) og tradisjonell glasskanyle (under) som benyttes til penetrering av embryoer.
Mikrokanylene framstilles ved overflate mikromaskinering der silisiumnitrid er materialet. Kanylene er mindre enn 5 mikrometer høye og kan være ned mot 5 mikrometer brede. Nålen på bildet er 30 mikrometer bred og gjør liten skade på embryoet. Bruddflaten på den tradisjonelle glasskanylen (t.h.) er derimot svært uregelmessig og ikke spesielt skarp. Foto: Stefan Zappe og John Xjzhang
Det første forskerne har fokusert på, har vært å utvikle kanyler ved hjelp av mikroteknologi. Kanylene framstilles ved såkalt overflate mikromaskinering der silisiumnitrid er materialet. Framstillingen er basert på de samme fabrikasjonsprosessene som benyttes for å produsere mikroprosessorer og annen mikroelektronikk. I tillegg til prosessene for standard elektronikk er det utviklet teknikker for mikromaskinering som gjør det mulig å lage kanaler, kaviteter, membraner, bjelker og andre tre-dimensjonale strukturer.
Kanylene som forskerne kan framstille, er mindre enn 5 mikrometer høye og kan være ned mot 5 mikrometer brede. Dette betyr at nålen lett kan stikkes inn i embryoet uten å gjøre for mye skade. Bruken av mikroteknologi gjør at vi har mye bedre kontroll på dimensjonene og dermed også bedre styring på hvor stor mengde som injiseres.
Ikke bare miniatyrisering
Denne formen for mikro- og nanoteknologi åpner for mange nye muligheter. I tillegg til miniatyrisering er den egnet til industriell framstilling av mikrokomponenter i høyt volum til lav pris. Kanskje enda viktigere er muligheten til å framstille todimensjonale matriser med et høyt antall nøyaktig like mikroelementer. Forskerne som jobber ved Stanford University, ønsker å utnytte dette til gjøre mange parallelle injeksjoner ved hjelp av opp til flere hundre mikrokanyler (figuren øverst viser et skisse til et slikt system.)
I et slikt eksperiment vil en også være avhengig av å kunne håndtere store antall embryoer med høy presisjon. En av strategiene for dette er å utvikle et mikrosystem der embryoene blir håndtert enkeltvis i mikrokanaler med strømmende væske styrt av mikroventiler og -pumper. Men forskerne arbeider også med teknologi for å feste embryoene i helt bestemte posisjoner slik at alle injektorene treffer nøyaktig der de skal. Dette oppnås ved at et gullmønster på en silisium- eller glasskive overflatebehandles på en spesiell måte. Når embryoene så skylles over denne strukturen, fester de seg på gullmønstret.
Mange muligheter
Ved Stanford University er man omtrent halvveis i det tre år lange prosjektet. Det er demonstrert at mikrokanylene kan brukes på fluefostrene til injeksjon, men foreløpig er ikke aktivt biologisk materiale sprøytet inn. Det er også utviklet ulike teknikker for å kunne bestemme og overvåke injisert mengde. En mikrobrikke for sortering av embryoer er også demonstrert, og forskerne har greid å gjøre embryoene ubevegelige.
I første omgang blir det forsøkt å forbedre eksisterende eksperimenter, og forskerne er kommet ganske langt i dette arbeidet. Det langsiktige målet er å muliggjøre eksperimenter som ikke lar seg gjennomføre med tradisjonell teknologi, f.eks. å kunne gjøre

Mikrokanyle (øverst) og tradisjonell glasskanyle (under) som benyttes til penetrering av embryoer.
Mikrokanylene framstilles ved overflate mikromaskinering der silisiumnitrid er materialet. Kanylene er mindre enn 5 mikrometer høye og kan være ned mot 5 mikrometer brede. Nålen på bildet er 30 mikrometer bred og gjør liten skade på embryoet. Bruddflaten på den tradisjonelle glasskanylen (t.h.) er derimot svært uregelmessig og ikke spesielt skarp. Foto: Stefan Zappe og John Xjzhang
injeksjoner i enkeltceller etter at embryoet har begynt å utvikle seg. Da må forskerne kunne framstille mikroinjektorer med dimensjoner på under 5 mikrometer.
Av Ralph W. Bernstein og Åse Dragland
Hva skjer i Norge?
Det er også miljøer i Norge som arbeider med denne typen embryoforskning. Professor Andrew Lambertsson ved Avdeling for molekylærbiologi ved Universitetet i Oslo arbeider f.eks. med injeksjon i bananflueembryoer. Førsteamanuensis Sigurd H. Fromm ved Institutt for oralbiologi, Laboratorium for molekylær embryologi har i flere år arbeidet med injeksjon, spesielt på embryoer fra mus. Han forteller at forskningen ikke bare dreier seg om å forstå utvikling av en organsime. De siste 15-20 år har mikroinjeksjon i zygoter av designede DNA-konstrukter (“transgener”) spilt en avgjørende rolle for utviklingen av moderne biomedisin, f.eks. når det gjelder å forstå utvikling og behandling av ulike kreftformer. Fromms gruppe startet arbeidet med å framstille transgene mus i 1984, og har fram til nå etablert langt over 1000 “founder”-mus, – i lang tid i samarbeid med Astra AB, Sverige.
Som kjent foregår det en nasjonal satsing på mikroteknologi også i Norge, og etablering av Norwegian Microtechnology Centre i Gaustabekkdalen. Som en del av denne satsingen har Forskningsrådet, SensoNor ASA, Norchip og SINTEF finansiert kompetanseprosjektet for Bernstein ved Stanford. I tillegg til å utføre forskning innen kombinasjonen mirkoteknologi og biomedisin skal Bernstein også knytte kontakter og kartlegge satsingen i amerikanske forskningsmiljøer.