Ukjent miljøaktør
Fenomenet har allerede gitt oss en renere verden, og genererer hver dag enorme inntekter. Men hva i all verden er katalyse?
Hver dag strømmer det naturgass fra Heidrun inn til en av verdens største metanolfabrikker på Tjeldbergodden på Nord-Møre. Her forvandles gassen til 830 000 tonn metanol i året. Det dekker 25 prosent av det europeiske markedet og ga STATOIL flere millioner i inntekt i fjor. Det som gjør dette mulig, er et kjemisk fenomen ved navn katalyse.
Mange kobler også ordet katalyse til rensing av eksos fra bensindrevne biler. Denne katalysatoren består av en mengde kanaler i keramisk materiale belagt med ørsmå partikler av edelmetallene platina og rhodium. Platinaen oksiderer karbonmonoksid og uforbrente hydrokarboner til karbondioksid (CO2) og vann, mens rhodium reduserer NOX til nitrogen og oksygen. Og vips – den bensindrevne bilmotoren forurenser mye mindre.
I tillegg til å gjøre lufta renere fører katalytiske prosesser også til klingende mynt. Omtrent tjue prosent av vårt brutto nasjonalprodukt produseres ved hjelp av den usynlige hjelperen.
– Over nitti prosent av alle prosesser innen kjemisk industri baseres på bruk av katalyse, forteller forsker Hilde Venvik ved SINTEF. Bensin, diesel, plast og kunstgjødsel er noen av produktene som blir til med katalyse som drivkraft. Med andre ord har katalyse svært stor betydning for verdiskapingen i hele den industrialiserte verden.
Mystisk hjelper
Trass i dette er katalysatoren en ganske ukjent hovedrolleinnehaver. Det er nemlig ikke så enkelt å forklare hva som skjer under en katalytisk prosess. Selv garvede forskere vet ennå ikke nøyaktig hva som skjer og hvorfor.
– Det finnes ingen enhetlig og altomfattende teori for katalyse. Derfor kan vi aldri forutsi med sikkerhet hva som vil skje med et uprøvd materiale eller når vi utformer nye kjemiske prosesser, forklarer Anders Holmen, professor i industriell kjemi ved NTNU og en av landets ledende eksperter på området.
– Se for deg en høydehopper som skal hoppe over et hinder. Idet han satser, dukker det opp en fyr som senker hinderet slik at hopperen lettere går over stanga. Omtrent det er det en katalysator gjør. Den gjør at kjemiske reaksjoner går “lettere” og dermed raskere, forklarer Hilde Venvik.
I Aschehoug og Gyldendals store norske leksikon kan du bl.a. lese dette om katalyse:
“En katalysator er et stoff som gjør at en kjemisk reaksjon øker eller nedsetter hastigheten av kjemiske reaksjoner. Katalysatoren finnes i mange varianter, i fast form som pulver eller pellets, som væske eller gass. Edelmetallene platina og palladium er eksempler på katalysatormaterialer. I den levende organisme finner vi også bio-katalysatorer, eller enzymer, disse spiller en fundamental rolle for livsprosessene.”
Katalyse er et overflatefenomen. Det betyr at alt skjer i grenseflaten mellom reaktantene (stoffene som skal reagere) og det katalytiske materialet. Det katalytiske materialet befinner seg derfor ofte som ørsmå partikler som sitter på et porøst materiale med stor overflate. Jo mer av det katalytiske materialet som grenser mot omgivelsene – jo mer av produktet får man. I prinsippet forbrukes ikke en katalytisk aktiv overflate. Den kan derfor ideelt sett produsere et uendelig antall produktmolekyler.
Det aller meste forskerne vet om katalyse, vet de takket være en rekke forsøk og en stor dose tålmodighet. Hele 10 000 tester lå til grunn for oppdagelsen av den katalytisk høytrykksprosessen for amoniakkproduksjon, som Haber og Bosch fikk nobelprisen i kjemi for, i henholdsvis 1918 og 1931. Prosessen gjorde det mulig å framstille ammoniakk direkte fra hydrogen og nitrogen. Ammoniakk er det viktigste råstoffet for framstilling av kunstgjødsel.

Bildet viser katalytisk spalting av hydrogenperoksid. Når hydrogenperoksidet kommer i kontakt med katalysatoren, som er et pulver av manganoksid, dannes oksygen som ses som bobler, samt vann.
Grønn kjemi
– Katalysatoren har stor betydning for miljøvennlig utnyttelse av naturgass, sier Hilde Venvik. Dette gjelder enten en ønsker å rense utslippene fra gasskraftverk for nitrogenoksider, eller en ønsker å produsere syntetisk diesel eller hydrogen. For å komme fram til et sluttprodukt, for eksempel hydrogen, ammoniakk eller bensin, må ofte mange katalytiske prosesser til. Framstillinga går i mange trinn, med mange uferdige “mellomprodukter” før siste stopp. Utfordringa for forskerne er derfor å finne praktiske løsninger som ikke tar så mye plass, og samtidig gjøre dette så billig og energieffektivt som mulig.
Hydrogenhjelperen
– Hydrogen kan bli en av framtidas energibærere på grunn av miljøfordelene.
– Utslippet fra en hydrogendrevet brenselcelle er som kjent bare rent vann. Men det krever at vi finner nye og smarte løsninger for både produksjon og håndtering av hydrogen.
Forskerne tror at katalyse vil spille en nøkkelrolle også her:
– Hydrogen kan for eksempel ikke tankes på samme måte som man tanker bensin eller diesel i dag, fordi stoffet krever ekstremt høye trykk eller lave temperaturer (-200 ºC), forteller Hilde.
I tillegg er hydrogen naturens minste molekyl, noe som gjør lagringsmediet svært utsatt for lekkasjer. Derfor må forskerne tenke nytt; kanskje finnes det andre metoder å skaffe seg hydrogen på. Ved SINTEF forskes det blant annet på å lage hydrogen av propan. Propan finnes i naturgass og kan enkelt lagres og fraktes på små eller store tanker.
– Kanskje kommer noen på bedre løsninger, men å finne katalysatorer som får kjemiske prosesser til å gå selektivt og energieffektivt er vår hovedutfordring, sier forskeren.
– En annen løsning kan være å omdanne hydrogenet til for eksempel metanol. Ved hjelp av katalyse kan metanolen omdannes til hydrogen inne i bilen, eller inne i PCen eller mobiltelefonen som en erstatning for batteri. En slik bil vil bare slippe ut CO2 og vann, og bidra til et mye renere miljø.
Tre retninger
Industriell utvikling av katalysatorer går i dag langs tre retninger. Det ene er å finne nye, alternative katalysatorer og katalytiske prosesser. I dag har vi kunnskap om et antall forskjellige katalysatorer, men forskerne vet at det finnes flere uprøvde systemer. Den tradisjonelle måten å finne dem på, er å prøve seg fram slik som Haaber og Bosch gjorde. Men det tar tid, og tid er penger. Metoder som kan gjøre denne letinga mer effektiv er derfor i forskernes søkelys:
Ved SINTEF har forskere funnet en løsning som nå gjør jakten på den rette katalysatoren litt lettere. En miniatyrisert trykkoker gjør det mulig å karakterisere hundrede forskjellige katalysatorer samtidig i stedet for en og en. Innretningen har fått navnet multiautoklave, og metoden som ligger bak teknologien, kalles parallell syntese eller kombinatorisk kjemi.
Verktøyet er nå i ferd med å bli et viktig hjelpemiddel for både forskere og industri i inn- og utland, blant annet fordi den gjør automatisering mulig. Allikevel; jakten på nye katalysatorer er en svært omfattende jobb. Noe av det forskerne jakter på, er nye og interessante katalysatorer, for eksempel rimeligere alternativer til katalytiske edelmetaller som er dyre og bare finnes i begrensede mengder. Kanskje kan kombinasjoner av lett tilgjengelige og billige grunnstoffer erstatte f.eks. platina?
Å optimalisere effekten av katalysatorer man allerede kjenner nytten av, er et annet viktig mål:
– I teorien kan en katalytisk prosess foregå i all uendelighet, men i praksis blir den etter hvert mindre effektiv. Derfor vil vi gjøre den mer effektiv ved å endre på trykk, temperatur og blandingen av de stoffene som skal reagere med hverandre, forklarer Hilde.
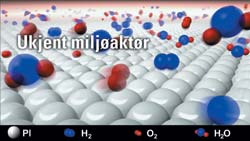
Katalytisk forbrenning illustrert på atomær skala. Hydrogen og oksygenmolekylene setter seg på platinaoverflaten (katalysatoren), splittes, og reagerer med vann (H2O). Prosessen genererer varme og ble derfor benyttet i de første lighterene.
Det tredje viktig feltet er selektivitet. Det vil si å være i stand til å produsere kun det ene stoffet man vil gjennom katalyse, og ikke en rekke biprodukter i tillegg.
– Biproduktene kan være store mengder giftige avfallsstoffer, spesielt innenfor finkjemi og farmasøytisk industri. Internasjonalt settes det strenge krav til håndtering av disse biproduktene. Jo renere prosess, jo bedre, sier hun.
I tillegg gjøres det viktig grunnforskning som går ut på å forklare hvordan katalysatorer virker, og å finne modeller som gjør oss bedre i stand til å finne nye katalysatorer og forutsi effekten av dem.
– Det er stor dynamikk og kort veg mellom grunnleggende forskning og industriell anvendelse på dette feltet, og vi har stort utbytte av å jobbe i et felles fagmiljø, understreker både Venvik og Holmen.
I framtida ser de for seg at det kan bli vanlig at biler får radiatorer med katalytisk belegg som renser lufta, eller at hus får miljøvennlige fasader med fliser som gjør det samme. At katalysatoren vil bli framtidas høyteknologiske miljøforkjemper, er begge forskerne enige om.



