Genial design
Syntetiske bakterier har gjort genteknologene til verdens mest betydningsfulle og kontroversielle designere.
Røros flyplass, januar 2009: Amerikaneren og vitenskapsmannen Craig Venter, den mest kjente bioteknologen i verden, har nylig landet med sin privatjet. I den lille ankomsthallen står SINTEF-forsker Trygve Brautaset. Han har fått forskerstjernen til å holde foredrag i den norske fjellheimen.

Trygve Brautaset på SINTEF jobber med å sette inn biter av «fremmed» DNA i celler. Slik får han en bakterie eller alge til å oppføre seg annerledes enn den opprinnelig er skapt til.
Foto: Thor Nielsen
Alt idet han går ut av flydøra og rusler ut i vinterkulden, er Venter en mann med status som en internasjonal popstjerne: Ikke nok med at han overrasket hele den vitenskapelige verden da han kartla alle genene i det menneskelige arvestoffet – genomet – i 2001, foran nesa på den internasjonale forskereliten. Like før Røros-turen er han tilbake i nyhetsbildet for fullt. Han vil skape syntetisk liv! Ett drøyt år seinere lykkes han: Våren 2010 lager han verdens første kunstige bakterie – og får den til å leve.
Designer cellefabrikker
I likhet med Craig Venter arbeider Trygve Brautaset og forskerkollegene hans i SINTEF med fagdisiplinen syntetisk biologi. Begge partene jobber med industriell bruk av mikroorganismer – som de har gitt nye egenskaper.
Venters mål er å ende opp med en syntetisk bakterie som effektivt kan bruke sollys og CO2 fra lufta til å lage fjerde generasjons biodrivstoff. Dit er han ikke kommet ennå. Men han har tatt det første steget ved å vise en forbløffet verden at han har greid å skifte ut alt av arvestoff i en bakterie med menneskeskapt DNA.
Brautaset og kollegene hans har på sin side erstattet bare en liten del av arvestoffet i «sine bakterier». Men også de har på egen hånd konstruert deler av arvestoffet de setter inn, og fått det produsert ved hjelp av datamaskiner og avansert kjemi.
– Hvis du ser for deg bakterier som frukt, så har Venter & co forvandlet appelsiner til epler, mens vi nøyer oss med å endre smaken og fargen på appelsinene – for å holde oss til lignelsen. Det vi gjør, er å endre ulike bakterier, slik at vi får nye organismer som kan produsere stoffer mennesker har nytte av. Dette kan være råstoff som benyttes i industriell produksjon, som for eksempel fargestoffer, enzymer, plastlignende materialer og antibiotika. Vi kaller bakteriene for cellefabrikker, sier Brautaset.
SINTEF-forskeren forklarer at både Venter og de selv i bunn og grunn ikke jobber med noe syntetisk: – Alle «byggeklossene» vi bruker, finnes i naturen fra før av. Det vi gjør, er å etterape det som skjer i naturlig evolusjon, bare veldig mye raskere og med klare mål.
Kampen om sukkeret
Vi står sammen med Trygve Brautaset i SINTEFs genetikk-lab på universitetsområdet Gløshaugen i Trondheim. Rundt oss sitter det unge mennesker i hvite frakker, dypt konsentrerte. Bøyd over små pipetter flytter de nesten usynlige dråper mellom ulike glasskåler.
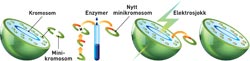
Slik endrer SINTEF-forskerne en bakterie
En bakterieart dyrkes for å gi nok materiale å arbeide med. Minikromosomene renses ut og deles opp. Det ønskede genet blir separert ut. Egenskapene til genet endres og plasseres inn i et nytt minikromosom. Det nye minikromosomet plasseres inn i bakterien ved hjelp av elektrosjokk. Det nye minikromosomet erstatter de originale minikromosomene. Bakteriens egenskaper er nå endret.
Ill: Raymond Nilsson
Nå har dette fagmiljøet nådd en milepæl: I konkurranse med fem andre internasjonale fagmiljøer har forskerteamet ved SINTEF blitt tilkjent ledertrøya i et prosjekt i regi av The European Science Foundation. Med andre ord: De har passert et nåløye som er usedvanlig trangt. Sammen med forskergrupper fra fem land skal Brautaset & co skape en bakterie som aldri før har sett dagens lys. Om de lykkes, vil den gjøre mer av verdens sukkerproduksjon tilgjengelig for matvareindustrien.
Bakterier bruker nemlig sukker som fôr når de jobber industrielt. Og i en befolkning på snart 6,5 milliarder er sukker mangelvare.
– Utfordringen vi har fått fra European Science Foundation, er å endre flere ulike bakterier slik at de kan bruke metanol som mat – i stedet for sukker, forklarer Brautaset.
I 2005 lyktes faggruppa fra SINTEF med å endre en bakterie som produserer aminosyren lysin – en svært viktig komponent i dyrefôr. Den nye bakterien kan nå livnære seg på naturgassen metanol og fortsatt lage sitt ettertraktede produkt.
– Om vi klarer å modifisere flere bakterier til å spise naturgass i stedet for sukker, vil det bli svært gunstig for Norge siden vi i dag har et overskudd av metanol, sier Brautaset med et smil.
Med DNA som byggeklosser
Det er hektisk aktivitet i laboratoriet rundt oss. Her inne lever et stort antall mikroorganismer – Norges minste «oppdrettsdyr» under kontrollerte betingelser. Og «røkterne» har en jobb som krever kirurgisk nøyaktighet og utrettelig tålmodighet. De isolerer DNA, og «klipper og limer» i arve-stoffet ved hjelp av enzymer. Mellom disse hvite veggene er genetisk manipulasjon og kloning like dagligdags som aviser og en kaffekopp.
– Å modifisere levende organismer er en møysommelig prosess. Hvert lille trinn er mange dagers jobb, forklarer Trygve Brautaset. – Det fascinerende er at vi aldri ser det vi jobber med. De ørsmå byggesteinene vi benytter, er ikke synlige for det blotte øye. Derfor bruker vi mer enn halvparten av tida til å teste om vi virkelig har fått resultater. Det er den eneste måten vi kan vite om vi har lyktes eller ikke.
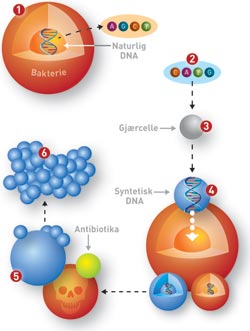
Slik har Craig Venter laget kunstig liv
1. Hele DNA-et til bakterien Mycoplasma Mycoides dekodes – dvs: rekkefølgen til byggesteinene i arvestoffet leses av.
2. Koden kopieres inn på PC. Presise endringer skrives inn. Innkjøpte DNA-fragmenter endres så etter den nye oppskriften. Ett fragment kodes for immunitet mot antibiotika.
3. De endrede DNA-bitene settes inn i gjærceller som limer dem sammen i riktig rekkefølge.
4. Det syntetiske DNA-et settes tilbake i bakterien, som så deler seg i to datterceller – en med naturlig og en med syntetisk DNA.
5. Antibiotika brukes til å drepe bakteriene med naturlig DNA. De syntetiske overlever og formerer seg.
6. På få timer slettes alle spor av den opprinnelige bakterien, mens bakteriene med syntetisk DNA vokser videre. Nytt liv er skapt!
Ill: Raymond Nilsson
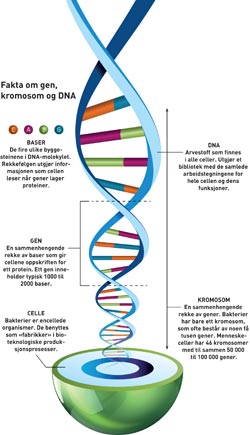
Syntetiske gener
Men hvordan kan man egentlig redesigne en levende organisme? Brautaset forklarer: – Syntetisk biologi er å sette inn biter av «fremmed» DNA i celler. Slik kan vi få en bakterie eller alge til å oppføre seg annerledes enn den opprinnelig er skapt til.
Det hele begynte med «rekombinant DNA-teknologi» – et fagfelt som ble til på 1970-tallet. Dette faget handlet lenge om å gå inn i en bakterie og «klippe» ut ett eller flere gener fra arvestoffet. Etterpå ble de utklippede genene «limt inn» i arvestoffet hos en bakterie av en annen type. Slik ble den nye vertsbakterien tilført en eller flere nye egenskaper.
Neste trinn i utviklinga av faget startet da det ble mulig å lage gener syntetisk. De siste årene har det gått an å sette sammen byggesteinene i arvestoffet etter en oppskrift som mennesker selv klekker ut – og ved hjelp av datamaskiner og kjemisk produksjonsutstyr. Slik har det blitt det mulig å «lime» syntetiske gener inn i arvestoffet til vertscellen. Og slik kan genteknologene i enda større grad enn før endre egenskapene til vertsbakterien.
Det Brautaset og gruppa hans gjør, er å lage ett eller flere kunstige gen fra scratch, basert på naturens egne byggesteiner, og så sette dette inn i arvestoffet til den nye bakterien. Da Craig Venter lagde sin verdensberømte bakterie – syntetiske Synthia – tok han enda et steg videre.
Endret hele kromosomet
Venter skapte en helt ny organisme gjennom å bruke en bakterie som «kart» for arbeidet sitt, og lyktes med å konstruere, produsere og lime sammen et komplett sett med syntetiske gener – det vil si et komplett syntetisk kromosom – i en vertsbakterie. For å bygge selve bakterien brukte han en svært enkel gjærcelle som redskap til å sette kromosomet sammen fra syntetiske DNA-biter og å kopiere opp dette kunstige kromosomet. Deretter tok han det nye kromosomet ut av gjærcellen og plasserte det inn i en bakteriecelle. Resultatet var at det kunstige kromosomet tok over for det naturlige kromosomet og dannet en helt ny bakterie.
Den vitenskapelige bragden fikk Time Magazine til å utpeke ham som en av verdens «People Who Mattered» i 2010.
– Alt dette er ren kjemi, men veldig ressurskrevende. Venter er utrolig dyktig og ambisiøs. I tillegg har han mektige støttespillere som gjør at han både kan skaffe de aller beste folkene til sine team – og finansiere det hele. Rent hypotetisk vil det kanskje bli mulig å lage syntetiske celler fra høyerestående dyr og mennesker med helt nye egenskaper en gang i framtida, sier Brautaset.
Milliarder av muligheter
Mens Brautaset har tegnet og forklart, har vi beveget oss over til kjemiblokka noen hundre meter unna genlaben. Her ligger et splitter nytt laboratorium som vil sette fart i arbeidet til trondheimsforskerne.
Laboratoriet er utstyrt med et bredt spekter av maskiner og roboter som alle utfører mikroskopiske prosedyrer i store serier.

På SINTEFs avdeling for Bioteknologi dyrkes det opp flere tusen ulike kolonier av bakterier. De må sorteres for å kunne dyrkes enkeltvis. Denne roboten gjør jobben. Ytterst på robotarmen er det et kamera og et «plukkehode» med 96 spisser, hver med en diameter på ca 1 mm.
Foto: Thor Nielsen
Tusenvis av bakterieprøver manipuleres og testes automatisk og samtidig døgnet rundt. I etasjen under det nye laboratoriet dyrkes «råstoffet» til forskerne – bakteriene. Her står det små gjæringstanker på rad og rekke, hvor mikroorganismer dyrkes og bakteriekolonier formeres i storskala under nøye overvåking.
– Utviklingen innenfor dette fagområdet har akselerert på kort tid, og kan sammenliknes med utviklingen innenfor IKT, hvor regnekapasiteten dobler seg for hvert år, forteller Brautaset. Hvert år kartlegges arvestoffet i tusenvis av biologiske organismer, og det gir forskerne milliarder av gener å velge mellom.
Årsaken er blant annet at maskiner på rekordtid gjør jobber som før tok tusenvis av manuelle arbeidstimer. Men billig er det ikke. En enkelt maskin har ofte en prislapp på flere millioner kroner. Skal man få framgang, trengs mange ulike roboter og beregningsmaskiner.
Gambling med naturen?
Mulighetene for å skape nye og nyttige organismer synes å være enorme. Men stadig flere advarer mot å tukle for mye med naturen. I Tromsø sitter en av dem. Terje Traavik er forskningssjef ved Genøk – Senter for biosikkerhet, som er opprettet for å jobbe for trygg bruk av genteknologi. Han mener at uforutsette egenskaper vil oppstå når man modifiserer eksisterende organismer i laboratoriene.
– Mutasjoner og genoverføring oppstår tilfeldig. Dette er essensen i evolusjon og biologi. Risikoen for at vi får uforutsette egenskaper, er til stede, derfor er det svært viktig å være varsomme når vi arbeider på området.
– Hovedoppgaven vår er å utføre forskning på biosikkerhet, basert på worst-case scenarier.
Craig Venter skapte «Synthia», en helt ny organisme, gjennom å bruke en bakterie som «kart» for arbeidet sitt, og lyktes i å konstruere, produsere og lime sammen et komplett syntetisk kromosom i en vertsbakterie.
Foto: J. Craig Venter Institute
Så langt er vi det eneste uavhengige forskningsinstitutt i verden med forskning på biosikkerhet som hovedformål, sier Traavik.
Kontinuerlig debatt
Trygve Brautaset er i stor grad ening med Traavik om føre-var-prinsippet, og synes Genøk har en viktig funksjon: – Visjonene og mulighetene til å skape helt nytt liv har både etiske og religiøse sider ved seg som må tas på alvor.
Han mener etisk debatt rundt konsekvenser og risiko knyttet til bioteknologi, har foregått helt siden rekombinant DNA-teknologi ble introdusert på 1970-tallet, og ser ikke syntetisk biologi som noe fundamentalt nytt, bare et naturlig steg videre innenfor bioteknologien:
– Jeg er helt enig i at vi skal ha en kontinuerlig debatt omkring dette fagfeltet, og registrerer at både European Science Foundation og EU krever at etiske betraktninger skal være integrert i alle prosjekter som nå utlyses innenfor syntetisk biologi.
I disse dager ferdigstiller Brautaset og forskerkollega Alexander Wentzel en ny stor EU søknad innenfor syntetisk biologi, med mange europeiske partnere fra både industrien og akademia. Dersom prosjektet får støtte, vil dette for alvor sette SINTEF på det internasjonale kartet innenfor syntetisk biologi.
Brautaset minnes samtalene med Craig Venter i den gnistrende vintersola på Røros:
– Både han og jeg skjønner folk kan bli urolige når de hører hva vi driver med. Men brukt under ansvar, kan den syntetiske biologien bli et av menneskets mest verdifulle verktøy.
Christina Benjaminsen og Svein Tønseth
Denne artikkelen er også publisert på EarthSky